4.3. Ķīmiskās saites veidošanās modelēšana
Kovalentā saite. Modelējot kovalentās saites veidošanos, ap ķīmisko elementu simboliem ar punktiem attēlo atomu ārējā līmeņa elektronus (sapārotos
un nesapārotos elektronus).
Kovalento saiti, kas veidojas starp elementiem ar vienādu relatīvo elektronegativitāti, sauc par nepolāro kovalento saiti.
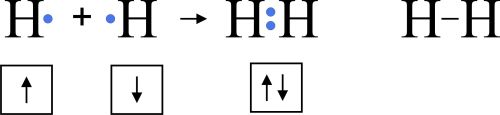

2.att. Kovalentas nepolāras saites vedošanās
Animācija
Kovalento saiti, kas veidojas starp elementiem ar atšķirīgu relatīvo elektronegativitāti, sauc par polāro kovalento saiti. Veidojoties ķīmiskajai saitei starp atomiem ar atšķirīgu relatīvo elektronegativitāti, kopīgais elektronu pāris ir novirzīts uz tā atoma pusi, kam ir lielāka relatīvā elektronegativitāte.


3.att. Kovalentas polāras saites veidošanās
Animācija
|
Kovalento saiti attēlo ar kopīgiem elektronu pāriem, iegūstot molekulu elektronformulas.
|
Kopīgo elektronu pāri apzīmējot ar svītriņu, iegūst molekulu struktūrformulas.
|
|
|
|
Jonu saite. Notiek vērtības elektronu pāreja no atoma ar mazāku relatīvo elektronegativitāti pie atoma ar lielāku relatīvo elektronegativitāti. Atomi, kuri atdod savus vērtības elektronus, pārvēršas par pozitīvi lādētiem joniem:
Na0 - e- → Na+.
Atomi, kas šos elektronus pievieno, pārvēršas par negatīvi lādētiem joniem:
Cl0+ e- → Cl-
Starp pozitīvi lādētiem un negatīvi lādētiem joniem darbojas savstarpējās elektrostatiskās pievilkšanās spēki, t.i., izveidojas jonu saite.
Na+ + Cl- → NaCl
Animācija