3. uzdevums
Aprēķini, cik gramu nogulšņu var iegūt, salejot kopā šķīdumu, kas satur 2,0 gramus nātrija hidroksīda, ar šķīdumu, kas satur 0,1 molu vara(II) sulfāta!
Atrisinājums
b) aprēķina NaOH daudzumu molos pēc formulas n = m/M, kur m - masa nātrija hidroksīdam šķīdumā, bet M – molmasa nātrija hidroksīdam.
n(NaOH) =2,0 g : 40 g/mol=0,05 mol
Tālāk
c) nosaka reaģējošo vielu un radušos nogulšņu daudzuma attiecības.
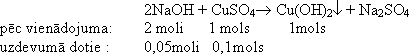
Tālāk
d) aprēķina, cik molu CuSO4 izreaģē ar 0,05 moliem NaOH, nosaka, kura no reaģējošām vielām ir pārākumā.
2NaOH + CuSO
4 → Cu(OH
2)↓ + Na
2SO
4
2 moli 1 mols
0.05 moli n moli
n(CuSO4)= 0,025 moli, tātad CuSO4 ir pārākumā
Tālāk
e) aprēķina nogulšņu daudzumu pēc NaOH daudzuma.
(Nogulšņu daudzumu var aprēķināt pēc izreaģējušā CuSO4 daudzuma!)
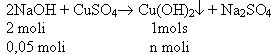
n (Cu(OH)2)= 0,025 moli
Tālāk
f) aprēķina nogulšņu masu pēc formulas m = n ∙ M( Cu(OH)2).
m(Cu(OH)2 )= 0,025 moli ∙ 98 g/mol= 2,45 g